Dermoid ve epidermoid tümörler, deri hücrelerinden ve deri bezlerinden gelişir ve genellikle beyin sapında veya omurilikte bulunur. Nadir gözlenen tümörlerdendir. Belirtileri diğer beyin tümörleri ile benzerdir ve baş ağrısı, bulantı, kusma, görme veya işitme kaybı gibi nörolojik semptomlar içerir.
Tedavisi, cerrahi müdahaledir ve tümörün boyutuna ve yerine bağlı olarak kemoterapi ve radyoterapi de gerekebilir. Cerrahi müdahale, tüm tümörün çıkarılmasını amaçlar, ancak tümörün çıkarılması bazen mümkün olmayabilir ve tümör tekrar edebilir.
Dermoid ve epidermoid tümörlerin nedeni tam olarak bilinmemektedir, ancak doğum öncesi gelişimsel anormallikler veya genetik faktörler gibi nedenlerle oluştuğu düşünülmektedir.
Bu tür beyin tümörleri nadir görülen olmalarına rağmen, çocukların nörolojik semptomlarını takip etmek ve erken teşhis ve tedavi için düzenli sağlık kontrolleri yaptırmak önemlidir. Erken teşhis ve tedavi, prognozu iyileştirebilir ve tümörün yayılmasını önleyebilir.
Dermoid Tümörlerde Enfeksiyon Riskleri
Dermoid tümörleri, nadir görülen benign (iyi huylu) tümörlerdir ve genellikle cerrahi müdahale ile tedavi edilirler. Enfeksiyon riski, tümörün yerine ve cerrahi müdahalenin nasıl yapıldığına bağlı olarak değişebilir.
Dermoid tümörler, içinde yağ, saç, diş, kemik veya diğer dokuları barındırabilen karmaşık tümörlerdir. Bu tür dokular, cerrahi müdahale sırasında patolojik materyal olarak çıkarılmalıdır. Cerrahi müdahale, tümörün tamamının çıkarılmasını amaçlar, ancak bazen tümörün tamamen çıkarılması mümkün olmayabilir.
Cerrahi müdahale sırasında tümörün içindeki materyallerin çıkarılması, enfeksiyon riskini artırabilir. Ayrıca, tümörün çıkarılması sırasında beyin dokusunda bir açıklık oluşur ve bu açıklık, enfeksiyon riskini artırabilir.
Enfeksiyon riskini azaltmak için, cerrahi müdahale sırasında steril teknikler kullanılmalı ve cerrahi sonrası antibiyotik tedavisi uygulanmalıdır. Cerrahi sonrası enfeksiyon belirtileri arasında ateş, kızarıklık, şişlik, ağrı veya baş ağrısı bulunabilir. Bu belirtiler varsa, derhal tıbbi yardım alınmalıdır.
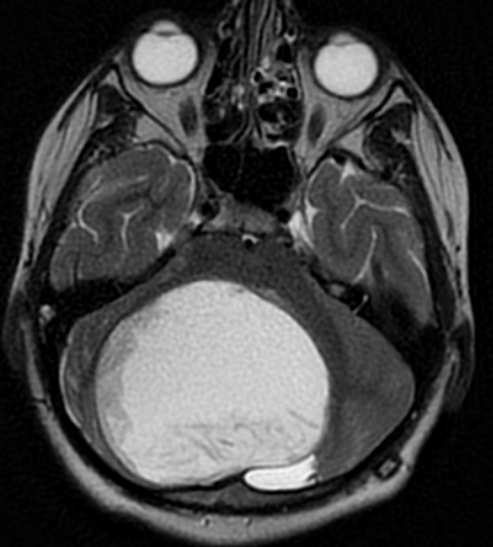
Epidermoid Tümörler
Epidermoid tümörler, beyin ve omurilikte nadir görülen tümörlerdir. Bu tümörler, vücudun diğer bölgelerinde bulunan epidermal hücrelerin (cilt, saç, tırnak, ter bezleri gibi) yerleştiği yerlerde ortaya çıkarlar. Epidermoid tümörler, dermoid tümörlerle benzerdir, ancak içerikleri farklıdır.
Epidermoid tümörler, yavaş büyüyen ve genellikle iyi huylu tümörlerdir. Genellikle beyin dokusunda bulunurlar, ancak nadir durumlarda omurilikte de görülebilirler. Epidermoid tümörler, içinde keratin adı verilen protein birikintileri bulunan kistik tümörlerdir.
Epidermoid tümörler genellikle belirti vermezler, ancak büyüdükçe basınç oluşturabilirler ve beyin fonksiyonlarına zarar verebilirler. Baş ağrısı, bulantı, kusma, nöbetler, görme sorunları, işitme kaybı, yüz kaslarında zayıflık veya uyuşukluk gibi semptomlar epidermoid tümörlerin varlığını gösterir.
Epidermoid tümörlerin tedavisi, cerrahi müdahale ile çıkarılmasıdır. Tümörün tamamen çıkarılması tedavinin en önemli amacıdır, ancak bazen tümörün tamamen çıkarılması mümkün olmayabilir. Cerrahi müdahale sonrası, hastaların genellikle tamamen iyileşmesi beklenir. Ancak, tümörün yerine, büyüklüğüne ve cerrahi müdahalenin nasıl yapıldığına bağlı olarak, bazı komplikasyonlar ortaya çıkabilir.
Çocukluk Çağı Fibröz Displazileri
Fibröz displazi, kemiklerdeki normal kemik dokusunun yerini fibröz (bağ dokusu benzeri) doku alması sonucu oluşan bir hastalıktır. Bu durum, çocukluk çağından erişkinliğe kadar olan yaşlarda görülebilir.
Fibröz displazi, genellikle kemiklerin birkaçında ortaya çıkar, ancak daha nadir durumlarda tüm kemikleri etkileyebilir. Bu durumun nedeni tam olarak bilinmemektedir, ancak mutasyonlarla ilişkili olduğu düşünülmektedir.
Fibröz displazi, ağrı, zayıflık, şekil bozukluğu, boy kısalığı ve kırılgan kemiklere neden olabilir. Kemiklerin yapısındaki değişiklikler, kemiklerin kolayca kırılmasına neden olabilir. Bu durum, kemik kırılmalarına ve eğriliklere neden olarak kalıcı sakatlıklara neden olabilir.
Fibröz displazinin tedavisi, semptomların şiddetine, hastalığın yaygınlığına ve yerine bağlıdır. Tedavi seçenekleri arasında ilaçlar, ameliyat ve kemik greftleri bulunur. Ağrı, kırıklar ve diğer semptomların kontrol altına alınması için ağrı kesiciler ve anti-inflamatuar ilaçlar da kullanılabilir.
Fibröz displazi, kemiklerde şekil bozukluğuna neden olabileceğinden, birçok hastada estetik nedenlerden dolayı tedavi gerekebilir. Bununla birlikte, fibröz displazi genellikle yavaş ilerleyen bir hastalık olduğundan, tedaviye yanıt veren birçok hasta uzun süre yaşayabilir ve iyi bir kalite yaşam sürdürebilir.
Kafada Fibröz Displazi
Fibröz displazi, kemiklerde normal kemik dokusunun yerini fibröz (bağ dokusu benzeri) doku alması sonucu oluşan bir hastalıktır. Bu durum, vücudun herhangi bir kemiklerinde görülebilir, ancak kafatası kemikleri gibi nadir görülen bölgelerde de olabilir.
Kafatası kemiklerindeki fibröz displazi, ağrı, baş ağrısı, kulak çınlaması, işitme kaybı, görme kaybı, çift görme, yüz asimetrisi, dişlerde kayma, diş kaybı ve kulakta dolgunluk hissi gibi semptomlara neden olabilir. Bunlar, beyin, kulak ve gözlerin yakınındaki kafatası kemiklerinin şekil bozukluğundan kaynaklanır.
Fibröz displazi, genellikle kemiklerin birkaçında ortaya çıkar, ancak daha nadir durumlarda tüm kemikleri etkileyebilir. Bu durumun nedeni tam olarak bilinmemektedir, ancak mutasyonlarla ilişkili olduğu düşünülmektedir.
Fibröz displazi, kemiklerde şekil bozukluğuna neden olabileceğinden, birçok hastada estetik nedenlerden dolayı tedavi gerekebilir. Tedavi seçenekleri arasında ilaçlar, ameliyat ve kemik greftleri bulunur. Ağrı, kırıklar ve diğer semptomların kontrol altına alınması için ağrı kesiciler ve anti-inflamatuar ilaçlar da kullanılabilir.
Kafatası kemiklerindeki fibröz displazi tedavisi, semptomların şiddetine, hastalığın yaygınlığına ve yerine bağlıdır. Tedaviye yanıt veren birçok hasta, uzun süre yaşayabilir ve iyi bir kalite yaşam sürdürebilir.
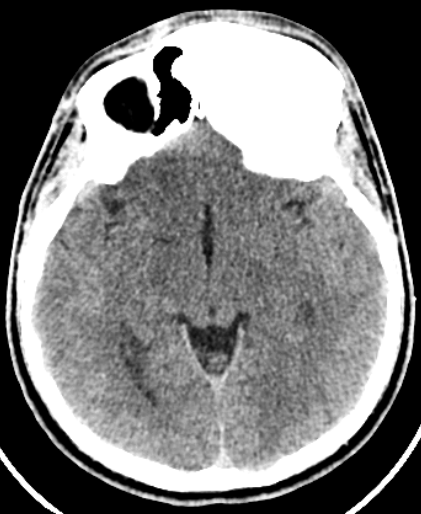
Beyinde Araknoid Kistler?
Araknoid kistler, beyin ve omuriliği örten zarlar arasında (araknoid zar) sıvı dolu keseciklerdir. Bu kistler genellikle doğuştan oluşur, ancak ilerleyen yaşlarda da ortaya çıkabilir.
Araknoid kistleri genellikle belirti vermezler ve sıklıkla tesadüfen beyin görüntüleme testleri sırasında rastlantısal olarak keşfedilirler. Ancak, büyük kistler çevre dokulara baskı yaparak baş ağrısı, nöbetler, bulantı, kusma, görme bozukluğu, denge sorunları ve hatta beyin hasarına neden olabilirler.
Küçük araknoid kistler genellikle tedavi gerektirmez, ancak semptomlara neden olan büyük kistler, cerrahi müdahale gerektirebilir. Bu müdahale, kistin boşaltılması veya kistin bağlantısının kesilerek sıvı akışının engellenmesi şeklinde olabilir. Ancak, cerrahi müdahale riskli olabilir ve sadece semptomları olan hastalar için önerilir.
Araknoid kistleri, beyindeki diğer tümörlerle karıştırılabilir, bu nedenle tanı koymak için bir beyin görüntüleme testi gereklidir. Kistlerin düzenli olarak izlenmesi, büyümelerini veya semptomlara neden olup olmadığını takip etmek için önemlidir.

Referanslar
- Yoko T. Udaka, MD Roger J. Packer, MD: Pediatric Brain Tumors REVIEW ARTICLE| VOLUME 36, ISSUE 3, P533-556, AUGUST 2018
- Siddhi Lokhande, Ujwala A. Shinde, Agnivesh Shrivastava, Kavita H. Singh, Targeting of lipid/polymeric (hybrid) nanoparticles to brain tumors, Nanocarriers for Drug-Targeting Brain Tumors, 10.1016/B978-0-323-90773-6.00027-0, (587-622), (2022).
- Liangliang Cao, Shuaiwei Tian, Wenkun Ma, Zhouwen Ni, Gang Tian, Yang Zhao, Qinhua Wang, Zhen Xu, Jiajia Wang, Zhuangzhuang Liang, Heng Zhao, Lingrui Yang, Baocheng Wang, Jie Ma, The tentative application of en bloc concept in the pediatric brain tumor: Experience from a large pediatric center in china, Frontiers in Oncology, 10.3389/fonc.2022.1018380, 12, (2022).
- R. D. C. Moon, P. Walsh, W. G. B. Singleton, A. Upex, R. J. Edwards, M. R. Carter, G. A. Fellows, Intra-operative neurophysiological mapping to identify distorted functional anatomy of the 4th ventricle in a 5-month-old infant, Child’s Nervous System, 10.1007/s00381-021-05356-9, 38, 7, (1371-1375), (2021).
- A McCauley Massie, Jonathan Ebelhar, Kristen E Allen, Nicholas P DeGroote, Karen Wasilewski-Masker, Katharine E Brock, Defining and timing of palliative opportunities in children with central nervous system tumors, Neuro-Oncology Practice, 10.1093/nop/npab020, 8, 4, (451-459), (2021).
- Abdelrhman Enayet, Brain tumors in the first two years of life, Egyptian Journal of Neurosurgery, 10.1186/s41984-021-00130-0, 36, 1, (2021).
- Tiziana Zilli, Valentina Dolcemascolo, Eva Passone, Marta Maieron, Maria Cristina De Colle, Miran Skrap, Tamara Ius, Ilaria Liguoro, Martina Venchiarutti, Paola Cogo, Barbara Tomasino, A multimodal approach to the study of children treated for posterior fossa tumor: A review of the literature and a pilot study, Clinical Neurology and Neurosurgery, 10.1016/j.clineuro.2021.106819, 207, (106819), (2021).
- Pinar Eser Ocak, Umut Ocak, Jiping Tang, John H. Zhang, The role of caveolin-1 in tumors of the brain – functional and clinical implications, Cellular Oncology, 10.1007/s13402-019-00447-x, 42, 4, (423-447), (2019).
- David T.W. Jones, Pratiti Bandopadhayay, Nada Jabado, The Power of Human Cancer Genetics as Revealed by Low-Grade Gliomas, Annual Review of Genetics, 10.1146/annurev-genet-120417-031642, 53, 1, (483-503), (2019).
- Peter M. Crean, Sandya Tirupathi, Essentials of Neurology and Neuromuscular Disorders, A Practice of Anesthesia for Infants and Children, 10.1016/B978-0-323-42974-0.00024-0, (561-580.e4), (2019).
- Tanya F. Panwala, Michelle E. Fox, Tiffany D. Tucker, Tricia Z. King, The Effects of Radiation and Sex Differences on Adaptive Functioning in Adult Survivors of Pediatric Posterior Fossa Brain Tumors, Journal of the International Neuropsychological Society, 10.1017/S135561771900033X, (1-11), (2019).
- B. Z. Chel’diev, Yu. V. Kushel’, M. O. Demin, Radicalness and complications of repeated surgery for malignant neuroepithelial tumors of the posterior cranial fossa in children, Voprosy neirokhirurgii imeni N.N. Burdenko, 10.17116/neiro201882051104, 82, 5, (104), (2018).
- Anuradha Banerjee, Theodore Nicolaides, Low-Grade Gliomas, Pediatric CNS Tumors, 10.1007/978-3-319-30789-3_1, (1-35), (2017).
- Georg Neuloh, Antoun Koht, Matthew C. Tate, Intraoperative Neurophysiologic Monitoring During Surgery for Supratentorial Mass Lesions, Monitoring the Nervous System for Anesthesiologists and Other Health Care Professionals, 10.1007/978-3-319-46542-5, (377-383), (2017).
- Kimberley Docking, Philippe Paquier, Angela Morgan, Childhood Brain Tumour, Research in Clinical Pragmatics, 10.1007/978-3-319-47489-2_6, (131-164), (2017).
- Michael J. Malcharek, Gerhard Schneider, Surgery for Infratentorial Mass, Monitoring the Nervous System for Anesthesiologists and Other Health Care Professionals, 10.1007/978-3-319-46542-5, (385-394), (2017).
- M. Afif, J. Khalil, F. Kouhen, S. Elmajjaoui, T. Kebdani, N. Benjaafar, Profil clinique et histologique des tumeurs du système nerveux central chez l’enfant à l’institut national d’oncologie de Rabat, MarocClinical and histological profile of pediatric tumors of the central nervous system at the National Institute of Oncology of Rabat, Morocco, Journal Africain du Cancer / African Journal of Cancer, 10.1007/s12558-015-0370-4, 7, 2, (111-114), (2015).
- Jonathan Lopez, Brain-Tumor-Related Epilepsy in Children, Epilepsy and Brain Tumors, 10.1016/B978-0-12-417043-8.00005-5, (65-99), (2015).
- Emily Hanzlik, Stacey E. Woodrome, Mohamed Abdel-Baki, Thomas J. Geller, Samer K. Elbabaa, A systematic review of neuropsychological outcomes following posterior fossa tumor surgery in children, Child’s Nervous System, 10.1007/s00381-015-2867-3, 31, 10, (1869-1875), (2015).
- Mohamed S Abdel-Baki, Emily Hanzlik, Mark W Kieran, Multidisciplinary pediatric brain tumor clinics: the key to successful treatment?, CNS Oncology, 10.2217/cns.15.1, 4, 3, (147-155), (2015).
- Martina Messing-Jünger, Michael Ehlen, Ehrenfried Schindler, Immediate Postoperative Care, Posterior Fossa Tumors in Children, 10.1007/978-3-319-11274-9, (825-840), (2015).
- Ram C. Kafle, Netra Khanal, Chris P. Tsokos, Bayesian age-stratified joinpoint regression model: an application to lung and brain cancer mortality, Journal of Applied Statistics, 10.1080/02664763.2014.927840, 41, 12, (2727-2742), (2014).
- Jeffrey Hatef, Cory Adamson, Oscar Obiga, Blessing Taremwa, Hussein Ssenyojo, Michael Muhumuza, Michael Haglund, Kristin Schroeder, Central Nervous System Tumor Distribution at a Tertiary Referral Center in Uganda, World Neurosurgery, 10.1016/j.wneu.2014.06.040, 82, 3-4, (258-265), (2014).
- Thomas Beez, Sevgi Sarikaya-Seiwert, Hans-Jakob Steiger, Daniel Hänggi, Fluorescence-guided surgery with 5-aminolevulinic acid for resection of brain tumors in children—a technical report, Acta Neurochirurgica, 10.1007/s00701-014-1997-9, 156, 3, (597-604), (2014).
- Robert F. Tamburro, Raymond Barfield, Amar Gajjar, Tumors of the Central Nervous System, Pediatric Critical Care Medicine, 10.1007/978-1-4471-6356-5, (555-568), (2014).
- Katherine E Warren, Roger J Packer, Current approaches to CNS tumors in infants and very young children, Expert Review of Neurotherapeutics, 10.1586/14737175.4.4.681, 4, 4, (681-690), (2014).
- James T Rutka, J Kuo, M Carter, A Ray, S Ueda, T Mainprize, Advances in the treatment of pediatric brain tumors, Expert Review of Neurotherapeutics, 10.1586/14737175.4.5.879, 4, 5, (879-893), (2014).
- M Karremann, U Rausche, D Roth, A Kühn, T Pietsch, G H Gielen, M Warmuth-Metz, R-D Kortmann, R Straeter, A Gnekow, J E A Wolff, C M Kramm, Cerebellar location may predict an unfavourable prognosis in paediatric high-grade glioma, British Journal of Cancer, 10.1038/bjc.2013.404, 109, 4, (844-851), (2013).
- Roberta McKean-Cowdin, Pedram Razavi, Jessica Barrington-Trimis, Rachel Tobias Baldwin, Shahab Asgharzadeh, Myles Cockburn, Tarik Tihan, Susan Preston-Martin, Trends in childhood brain tumor incidence, 1973–2009, Journal of Neuro-Oncology, 10.1007/s11060-013-1212-5, 115, 2, (153-160), (2013).
- Javier Vicente, Elies Fuster-Garcia, Salvador Tortajada, Juan M. García-Gómez, Nigel Davies, Kal Natarajan, Martin Wilson, Richard G. Grundy, Pieter Wesseling, Daniel Monleón, Bernardo Celda, Montserrat Robles, Andrew C. Peet, Accurate classification of childhood brain tumours by in vivo 1H MRS – A multi-centre study, European Journal of Cancer, 10.1016/j.ejca.2012.09.003, 49, 3, (658-667), (2013).
- Michael J. Malcharek, Gerhard Schneider, Surgery for Infratentorial Mass, Monitoring the Nervous System for Anesthesiologists and Other Health Care Professionals, 10.1007/978-1-4614-0308-1, (417-431), (2013).
- Georg Neuloh, Antoun Koht, Surgery for Supratentorial Mass, Monitoring the Nervous System for Anesthesiologists and Other Health Care Professionals, 10.1007/978-1-4614-0308-1, (407-416), (2013).
- Soonmee Cha, Brain Cancer: Evidence-Based Neuroimaging, Evidence-Based Neuroimaging Diagnosis and Treatment, 10.1007/978-1-4614-3320-0, (419-438), (2013).
- Dong-Anh Khuong-Quang, Pawel Buczkowicz, Patricia Rakopoulos, Xiao-Yang Liu, Adam M. Fontebasso, Eric Bouffet, Ute Bartels, Steffen Albrecht, Jeremy Schwartzentruber, Louis Letourneau, Mathieu Bourgey, Guillaume Bourque, Alexandre Montpetit, Genevieve Bourret, Pierre Lepage, Adam Fleming, Peter Lichter, Marcel Kool, Andreas von Deimling, Dominik Sturm, Andrey Korshunov, Damien Faury, David T. Jones, Jacek Majewski, Stefan M. Pfister, Nada Jabado, Cynthia Hawkins, K27M mutation in histone H3.3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas, Acta Neuropathologica, 10.1007/s00401-012-0998-0, 124, 3, (439-447), (2012).
- Christine A. Matarese, Kenneth J. Mack, Headache and Head Pain, Textbook of Clinical Pediatrics, 10.1007/978-3-642-02202-9, (3581-3593), (2012).
- Vered Shay, Aviva Fattal-Valevski, Liana Beni-Adani, Shlomi Constantini, Diagnostic delay of pediatric brain tumors in Israel: a retrospective risk factor analysis, Child’s Nervous System, 10.1007/s00381-011-1564-0, 28, 1, (93-100), (2011).
- Matthew J Burfeindt, Earl Zastrow, Susan C Hagness, Barry D Van Veen, Joshua E Medow, Microwave beamforming for non-invasive patient-specific hyperthermia treatment of pediatric brain cancer, Physics in Medicine and Biology, 10.1088/0031-9155/56/9/007, 56, 9, (2743-2754), (2011).
- S. J. Hipp, E. Steffen-Smith, D. Hammoud, J. H. Shih, R. Bent, K. E. Warren, Predicting outcome of children with diffuse intrinsic pontine gliomas using multiparametric imaging, Neuro-Oncology, 10.1093/neuonc/nor076, 13, 8, (904-909), (2011).
- U. Löbel, D.W. Ellison, B.L. Shulkin, Z. Patay, Infiltrative cerebellar ganglioglioma: conventional and advanced MRI, proton MR spectroscopic, and FDG PET findings in an 18-month-old child, Clinical Radiology, 10.1016/j.crad.2010.10.005, 66, 2, (194-201), (2011).
- Jonathan A. Forbes, Adam S. Reig, Jason G. Smith, Walter Jermakowicz, Luke Tomycz, Sheila D. Shay, David A. Sun, Curtis A. Wushensky, Matthew M. Pearson, Findings on Preoperative Brain MRI Predict Histopathology in Children with Cerebellar Neoplasms, Pediatric Neurosurgery, 10.1159/000329627, 47, 1, (51-59), (2011).
- E.A. Quintero-Gallego, C.M. Gómez, M. Morales, J. Márquez, Spatial orientation deficit in children due to cerebellum astrocytoma pediatric tumor obtained by means of the Attentional Network Test, Neuroscience Letters, 10.1016/j.neulet.2011.09.034, 504, 3, (232-236), (2011).
- Soonmee Cha, 8 Imaging of Brain Cancer, Evidence-Based Imaging, 10.1007/978-1-4419-7777-9, (127-146), (2011).
- Kyle E. Ferguson, Grant L. Iverson, Mike R. Schoenberg, Brain Tumors, The Little Black Book of Neuropsychology, 10.1007/978-0-387-76978-3, (787-811), (2011).
- Jonathan A. Forbes, Lola B. Chambless, Jason G. Smith, Curtis A. Wushensky, Richard L. Lebow, JoAnn Alvarez, Matthew M. Pearson, Use of T2 signal intensity of cerebellar neoplasms in pediatric patients to guide preoperative staging of the neuraxis, Journal of Neurosurgery: Pediatrics, 10.3171/2010.11.PEDS10312, 7, 2, (165-174), (2011).
- GREGORY J. LATHAM, ROBERT S. GREENBERG, Anesthetic considerations for the pediatric oncology patient – part 2: systems‐based approach to anesthesia, Pediatric Anesthesia, 10.1111/j.1460-9592.2010.03260.x, 20, 5, (396-420), (2010).
- Adam T. Schmidt, Rebecca B. Martin, Arzu Ozturk, Wendy R. Kates, Moody D. Wharam, E. Mark Mahone, Alena Horská, Neuroimaging and neuropsychological follow-up study in a pediatric brain tumor patient treated with surgery and radiation, Neurocase, 10.1080/13554790903329133, 16, 1, (74-90), (2010).
- Gregory Gan, Daphne Haas-Kogan, Low-Grade Gliomas, Pediatric CNS Tumors, 10.1007/978-3-540-87979-4_1, (1-35), (2010).
- Soonmee Cha, Imaging of Brain Neoplasm, Evidence-Based Imaging in Pediatrics, 10.1007/978-1-4419-0922-0, (103-114), (2010).
- Cristina Traggiai, Richard Stanhope, Evaluation and Management of Childhood Hypothalamic and Pituitary Tumors, Endocrinology, 10.1016/B978-1-4160-5583-9.00020-4, (377-385), (2010).
- Jane Kim, Soonmee Cha, Heike E. Daldrup-Link, Robert Goldsby, Pediatric tumors, Essentials of Pediatric Radiology, 10.1017/CBO9780511777516, (181-219), (2010).
- Peter Crean, Elaine Hicks, Essentials of Neurology and Neuromuscular Disease, A Practice of Anesthesia for Infants and Children, 10.1016/B978-141603134-5.50026-3, (491-507), (2009).
- Stephan D. Voss, Diagnostic Imaging in the Evaluation of Childhood Cancer, Oncology of Infancy and Childhood, 10.1016/B978-1-4160-3431-5.00026-1, (1015-1098), (2009).
- Abderrahmane Hamlat, Stephan Saikali, Sylma Diabira, Mahmoud Messerer, Laurent Riffaud, Diagnosis of childhood astrocytomas, Expert Opinion on Medical Diagnostics, 10.1517/17530050903032679, 3, 5, (501-522), (2009).
- Robert Tamburro, Raymond C. Barfield, Amar Gajjar, Tumors of the Central Nervous System, The Central Nervous System in Pediatric Critical Illness and Injury, 10.1007/978-1-84800-993-6, (1-8), (2009).
- Jason Fangusaro, Susan Chi, Introduction to a Special Issue on Pediatric Neuro-Oncology, Journal of Child Neurology, 10.1177/0883073809338959, 24, 11, (1341-1342), (2009).
- Hans Thulesius, Jana Pola, Anders Håkansson, Diagnostic Delay in Pediatric Malignancies – A Population-based Study, Acta Oncologica, 10.1080/028418600750063640, 39, 7, (873-876), (2009).
- Karel Kukal, Milana Dobrovoljac, Eugen Boltshauser, Roland A. Ammann, Michael A. Grotzer, Does diagnostic delay result in decreased survival in paediatric brain tumours?, European Journal of Pediatrics, 10.1007/s00431-008-0755-5, 168, 3, (303-310), (2008).
- Ann Klasner, Brain Tumor, Pediatric Emergency Medicine, 10.1016/B978-141600087-7.50048-9, (385-387), (2008).
- David Cantelmi, Tom A Schweizer, Michael D Cusimano, Role of the cerebellum in the neurocognitive sequelae of treatment of tumours of the posterior fossa: an update, The Lancet Oncology, 10.1016/S1470-2045(08)70148-7, 9, 6, (569-576), (2008).
- M. Douglas Ris, Dean W. Beebe, Neurodevelopmental outcomes of children with low‐grade gliomas, Developmental Disabilities Research Reviews, 10.1002/ddrr.27, 14, 3, (196-202), (2008).
- N. P. Davies, M. Wilson, L. M. Harris, K. Natarajan, S. Lateef, L. MacPherson, S. Sgouros, R. G. Grundy, T. N. Arvanitis, A. C. Peet, Identification and characterisation of childhood cerebellar tumours by in vivo proton MRS, NMR in Biomedicine, 10.1002/nbm.1283, 21, 8, (908-918), (2008).
- Bettina C. Reulecke, Christian G. Erker, Barbara J. Fiedler, Thomas-Ulrich Niederstadt, Gerhard Kurlemann, Brain Tumors in Children: Initial Symptoms and Their Influence on the Time Span Between Symptom Onset and Diagnosis, Journal of Child Neurology, 10.1177/0883073807308692, 23, 2, (178-183), (2007).
- Adriana Ávila de Espíndola, Hamilton Matushita, Juliana Martins Pimenta, Ana Cristina da Silva Fernandes, Sérgio Rosemberg, Umbertina Conti Reed, Brain tumors in the first three years of life: a review of twenty cases, Arquivos de Neuro-Psiquiatria, 10.1590/S0004-282X2007000600007, 65, 4a, (960-964), (2007).
- Marcos A. Santos, Célia M.P. Viégas, Renata A. Servidoni, Mario H.M. Barros, Maria Isabel Pinel, Carlos M.M. Araújo, Timing of radiation in children with medulloblastoma/PNET, Pediatric Blood & Cancer, 10.1002/pbc.21049, 48, 4, (416-422), (2007).
- Lutz Dörner, Michael J. Fritsch, Andreas M. Stark, Hubertus Maximilian Mehdorn, Posterior fossa tumors in children: how long does it take to establish the diagnosis?, Child’s Nervous System, 10.1007/s00381-007-0323-8, 23, 8, (887-890), (2007).
- Seung Jeong Han, Yun Hee Kim, Young Se Kwon, Yong Hoon Jun, Soon Ki Kim, Byong Kwan Son, Clinical features of children’s brain tumors according to location, Korean Journal of Pediatrics, 10.3345/kjp.2006.49.1.76, 49, 1, (76), (2006).
- Sefer Kumandaş, Hüseyin Per, Hakan Gümüş, Bülent Tucer, Ali Yikilmaz, Olgun Kontaş, Abdülhakim Coşkun, Ali Kurtsoy, Torticollis secondary to posterior fossa and cervical spinal cord tumors: report of five cases and literature review, Neurosurgical Review, 10.1007/s10143-006-0034-8, 29, 4, (333-338), (2006).
- Stephen J. Monteith, Peter A. Heppner, Michael J. Woodfield, Andrew J.J. Law, Paediatric central nervous system tumours in a New Zealand population: A 10-year experience of epidemiology, management strategies and outcomes, Journal of Clinical Neuroscience, 10.1016/j.jocn.2005.08.013, 13, 7, (722-729), (2006).
- Soonmee Cha, Imaging of Brain Cancer, Evidence-Based Imaging, 10.1007/0-387-31216-1, (102-118), (2006).
- Jill S. Barnholtz-Sloan, Richard K. Severson, Bonita Stanton, Merlin Hamre, Andrew E. Sloan, Pediatric brain tumors in Non-Hispanics, Hispanics, African Americans and Asians: differences in survival after diagnosis, Cancer Causes & Control, 10.1007/s10552-004-7843-2, 16, 5, (587-592), (2005).
- Cornelia S. von Koch, John H. Chi, Nalin Gupta, Cerebellar Astrocytomas, Textbook of Neuro-Oncology, 10.1016/B978-0-7216-8148-1.50084-X, (617-626), (2005).
- Diane Puccetti, Brain Tumors, Pediatrics, 10.1016/B978-0-323-01199-0.50170-5, (1104-1108), (2005).
- Dean W. Beebe, M. Douglas Ris, F. Daniel Armstrong, John Fontanesi, Raymond Mulhern, Emi Holmes, Jeffrey H. Wisoff, Cognitive and Adaptive Outcome in Low-Grade Pediatric Cerebellar Astrocytomas: Evidence of Diminished Cognitive and Adaptive Functioning in National Collaborative Research Studies (CCG 9891/POG 9130), Journal of Clinical Oncology, 10.1200/JCO.2005.06.117, 23, 22, (5198-5204), (2005).
- M. Douglas Ris, Patricia McDonough Ryan, Michael Lamba, John Brenemen, Kim Cecil, Paul Succop, William Ball, An improved methodology for modeling neurobehavioral late‐effects of radiotherapy in pediatric brain tumors, Pediatric Blood & Cancer, 10.1002/pbc.20251, 44, 5, (487-493), (2004).
- J. H. Chi, N. Gupta, Cerebellar Astrocytomas, Pediatric CNS Tumors, 10.1007/978-3-662-09227-9_3, (27-47), (2004).
- Yutaka Sawamura, Chemotherapy for Pediatric Brain Tumors, Japanese Journal of Neurosurgery, 10.7887/jcns.12.405, 12, 6, (405-411), (2003).
- E. E. O. Hagebeuk, J. de Kraker, B. T. Poll-The, Failure to thrive: denk ook aan een hersentumor, Tijdschrift voor kindergeneeskunde, 10.1007/BF03061417, 71, 6, (11-16), (2003).
- Nicole J Ullrich, Scott L Pomeroy, Pediatric brain tumors, Neurologic Clinics, 10.1016/S0733-8619(03)00014-8, 21, 4, (897-913), (2003).
- Judith Könemann, Judith Könemann, Die Moderne und ihre Auswirkungen auf das Verständnis und die Lebenspraxis von Religion und Religiosität, „Ich wünschte, ich wäre gläubig, glaub’ ich.“, 10.1007/978-3-663-09176-9, (20-141), (2002).
- James G. Gurney, Malcolm A. Smith, Andrew F. Olshan, Stephen S. Hecht, Christine M. Kasum, Clues to the Etiology of Childhood Brain Cancer: N-Nitroso Compounds, Polyomaviruses, and Other Factors of Interest, Cancer Investigation, 10.1081/CNV-100104291, 19, 6, (630-640), (2001).
- Robert J. Weil, Zhengping Zhuang, Svetlana Pack, Shimareet Kumar, Lee Helman, Brian G. Fuller, Crystall L. Mackall, Edward H. Oldfield, Intramedullary Ewing sarcoma of the spinal cord: consequences of molecular diagnostics, Journal of Neurosurgery: Spine, 10.3171/spi.2001.95.2.0270, 95, 2, (270-275), (2001).
- Mark W. Kieran, Advances in pediatric neuro-oncology, Current Opinion in Neurology, 10.1097/00019052-200012000-00003, 13, 6, (627-634), (2000).
- Ian F. Pollack MD; Pediatric brain tumors Special Issue: Pediatric Surgical Oncology March 1999 Volume16, Issue 2 Pages 73-90
- Ostrom Q.T. Gittleman H. Xu J. et al.CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2009-2013. Neuro Oncol. 2016; 18: v1-v75
- Zhang J. Walsh M.F. Wu G. et al. Germline mutations in predisposition genes in pediatric cancer. N Engl J Med. 2015; 373: 2336-2346
- Ron E. Modan B. Boice Jr., J.D. et al. Tumors of the brain and nervous system after radiotherapy in childhood. N Engl J Med. 1988; 319: 1033-1039
- Wilne S. Collier J. Kennedy C. et al. Presentation of childhood CNS tumours: a systematic review and meta-analysis. Lancet Oncol. 2007; 8: 685-695
Derleyen: Dr. Mustafa Akgun
Son Güncelleme Tarihi: 26.02.2023
Anahtar Kelimeler: Beyin tümörü, Pediatrik beyin tümörleri, Medulloblastom, Astrocytom, Kraniofaringiyom, Ependimom, Gliom, Pineal Bölge Tümörleri, Mezenkimal Tümörleri, Dermoid, Epidermoid Tümörler, Beyinde Araknoid Kistler, Fibröz Displaziler,Belirtiler, Tanı, Tedavi, Cerrahi müdahale, Radyoterapi, Kemoterapi, İmmünoterapi, Prognoz, Nörolojik sonuçlar, Rehabilitasyon, Psikososyal etkiler, Aile desteği, Alternatif tedaviler



